미국 FDA는 지난 20일(한국시간) 코오롱티슈진의 인보사 미국 임상 재개 요청에 대해 “인보사의 임상 중단 유지(Continue Clinical Hold) 및 추가 보완 자료를 제출하라”는 공문을 보냈다.
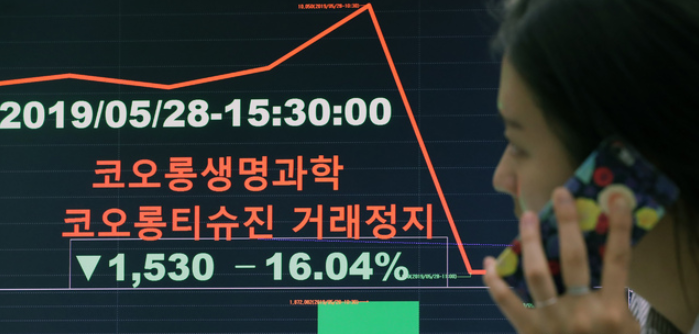
앞서 FDA는 지난 5월 3일 코오롱티슈진 인보사의 미국 임상 3상에 대해 ‘임상중지(Clinical Hold)’를 통보했다.
그러면서 인보사 구성 성분에 대한 특성 분석, 성분 변화 발생 경위, 향후 조치사항 등 제출을 요구했다. 이후 지난달 23일 코오롱티슈진은 이들 자료를 FDA에 제출했다.
하지만 FDA는 한 달간의 검토 끝에 바로 임상 재개를 허락하지 않고 ‘임상 보류’를 유지하면서 추가 자료 제출을 요구했다.
추가 보완을 요구한 부문은 ▲인보사 1액(HC)의 연골세포 특성 분석 자료 보완 ▲2액(TC)의 gag, pol 유전자 염기서열분석 및 방사선 조사 전·후의 TC세포에 외피 유전자를 각 도입 후 레트로바이러스 생성 여부 확인이다.
일단 코오롱티슈진 측은 임상 3상 재개를 위한 미국 FDA의 추가 자료 제출 요청사항은 충분히 해결 가능한 것이라는 입장이다.
코오롱티슈진 측은 “FDA가 요청한 자료들은 향후 실험 등을 통해 충분히 해결할 수 있는 내용으로 판단하고 있다”며 “Clinical hold는 지속되나 임상 3상 재개여부 검토과정의 절차로 볼 수 있으며 과거에도 추가 보완 자료 제출 등을 통해 Clinical hold를 해제했었다”고 밝혔다.
이번 FDA의 추가자료 요청이 코오롱티슈진 상장폐지 심사에도 적지 않은 영향을 미칠 것으로 예상된다.
코스탁시장위원회가 인보사 ‘임상 중단 유지’를 결정하면서 추가자료를 요청한 의도를 어떻게 해석할 것인가에 따라 결정이 바뀔 것으로 보인다.
회사가 자신한 대로 임상 재개의 기회로 볼지, 아니면 임상 재개 여부가 여전히 불투명한 상황으로 판단할지에 따라 다르다.
한국거래소 관계자는 <뉴시스>에 “지난 18일 코스닥시장위원회 개최를 연기한 것은 미국 FDA의 결정을 기다리기 위한 목적이 강했다”며 “이번 FDA 레터의 내용이 다음에 열릴 코스닥시장위원회(10월11일 기한) 심사에 반영될 것”이라고 설명했다.
FDA가 여전히 임상 보류를 유지하면서 향후 임상 재개는 여전히 불확실성이 존재한다.
다만 FDA가 인보사 임상 보류의 원인으로 지목된 주성분 변경 논란과 관련해서는 추가 자료 제출을 요구하지 않아 임상 재개가 유력하다는 의견도 나온다.
코오롱티슈진 관계자는 ““그간 회사의 노력으로 FDA의 요청 사항이 상당부분 해소됐다”며 “이번 레터는 자료의 보완을 통해 향후 임상개발을 재개할 수 있는 기회를 제공한 것”이라고 말했다.
[사진제공=뉴시스]
스페셜경제 / 김다정 기자 92ddang@speconomy.com