 |
[스페셜경제=문수미 인턴기자]식품의약품안전처는 27일 코로나19 치료제와 백신 개발을 준비 중인 제약사를 대상으로 임상시험을 우선·신속 심사하고 있다고 이날 밝혔다.
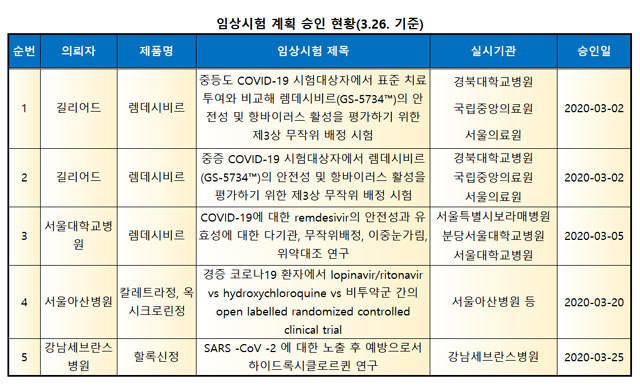
식약처에 따르면 현재 코로나19 치료와 관련한 임상시험 11건이 신청돼 대한감염학회·대한항균요법학회 등 전문가 자문을 거쳐 5건이 승인됐다.
이중 에볼라 치료제의 ▲렘데시비르 관련 임상 3건 ▲칼레트라(인체 면역결핍 바이러스 감염 치료제)와 히드록시클로로퀸(말라리아 치료제) 관련 임상 1건 ▲히드록시클로로퀸정 임상 1건 등이다.
아울러 인플루엔자 치료제로 임상시험 중인 의약품을 코로나19 치료에 사용하도록 6건을 승인했다. 모두 이뮨메드의 ‘HzVSF v13’이다. 이뮨메드의 6건 이외 10건의 치료목적 사용승인 요청도 검토중이다.
식약처는 생명이 위급하거나 대체 치료수단이 없는 응급환자 등의 치료를 위해 허가되지 않은 임삼시험용 의약품이더라도 별도 승인을 받아 사용할 수 있도록 하고 있다.
한편 현재 백신 개발 계획을 발표한 국내 제약바이오 기업은 SK바이오사이언스, GC녹십자, 신라젠 등이다.
[사진출처=뉴시스]
스페셜경제 / 문수미 기자 tnal9767@speconomy.com